实验室制二氧化硫原理(二氧化硫与二氧化碳的比较)
二氧化硫与二氧化碳都是重要的非金属氧化物,二者有许多相似和不同的地方。
在通常情况下,都是无色气体,都能溶于水,但SO2的溶解度更大一些。SO2有毒、有刺激性气味,CO2无毒、无味。
SO2是一种环境污染物,能导致酸雨的形成,CO2的排放也能导致温室效应。
一、SO2和CO2的实验室制备
(1)反应原理:
实验室可用亚硫酸钠固体与较浓的硫酸反应制取二氧化硫气体。
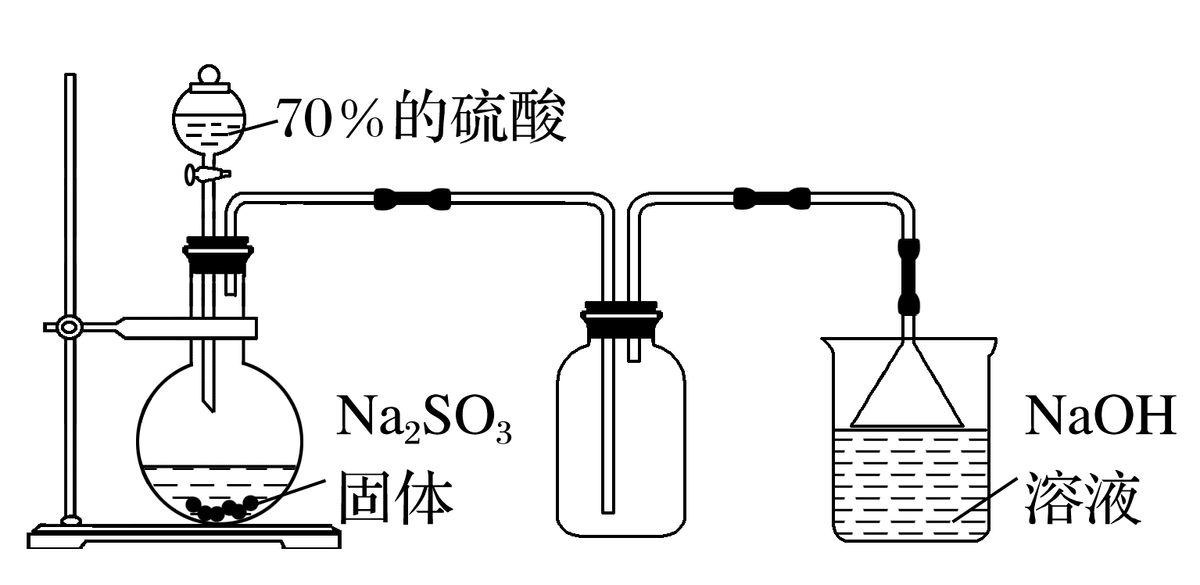
实验室用大理石或石灰石与稀盐酸反应制取二氧化碳气体。
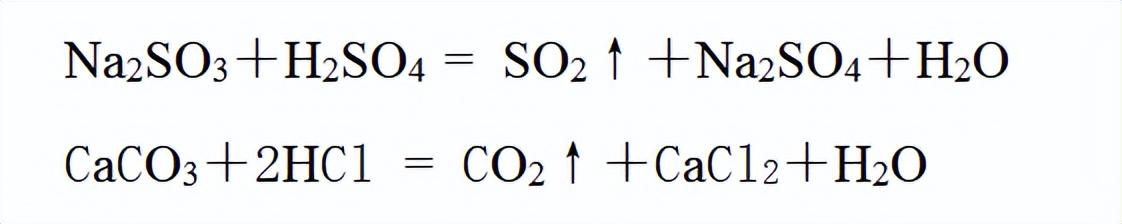
(2)实验装置:
两种气体都是用固体和液体反应制取,都不需要加热。所以都可用“固体+液体→气体”的发生装置。
两者都能溶于水,不适合用排水法收集。密度都比空气大,均可用瓶口向上的排空气法收集。
不同的是 SO2有毒,所以必须有尾气处理装置,一般用NaOH溶液吸收多余的 SO2,防止其污染环境。而 CO2无毒,不需要尾气处理装置。
SO2很容易溶解于NaOH溶液,还需要考虑防倒吸的问题。
二氧化硫有漂白性,一般用品红溶液检验,溶液会褪色。二氧化碳一般用澄清石灰水检验。
要注意的是,二氧化硫也可能使澄清石灰水变浑浊,不过由于二氧化硫溶解度较大,而石灰水的浓度较小,实际检验中二氧化硫很容易过量,往往不会产生浑浊,而且二氧化硫很容易用漂白性区别,所以仍然可以用澄清石灰水检验二氧化碳。
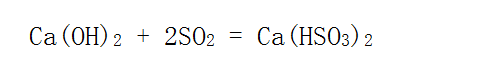

2、SO2和CO2的鉴别与除杂
SO2与CO2的化学性质也同样有相似和不同的地方。
它们都是酸性氧化物,都有酸性氧化物的性质:
与碱反应生成盐和水,其对应的酸,亚硫酸和碳酸都是二元弱酸,都不稳定易分解。
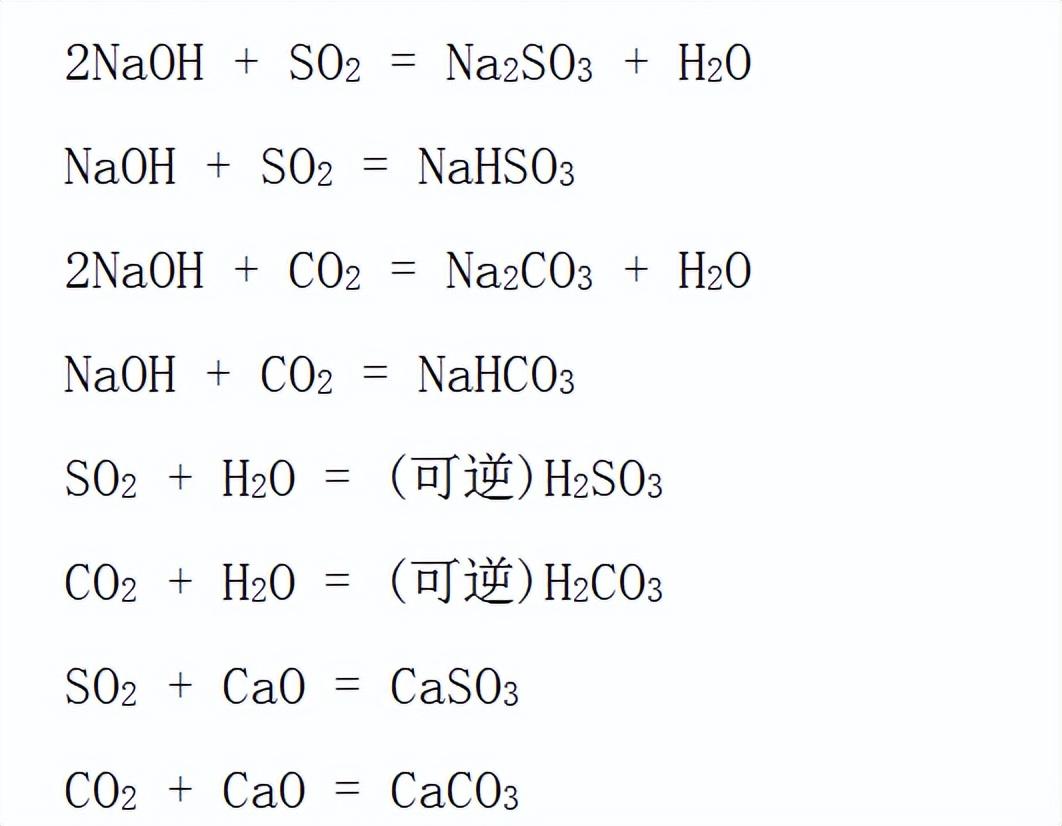
二者都有弱氧化性,比如:

二氧化硫有强还原性、漂白性,而二氧化碳没有。
1、SO2与CO2的鉴别
SO2和CO2都能使澄清石灰水变浑浊,继续通入过量的气体,沉淀都会消失,故不能用Ca(OH)2鉴别。
可利用SO2的漂白性,能使品红溶液褪色的是SO2,不褪色的是CO2。
还可利用SO2的还原性,通入酸性KMnO4溶液或溴水等中,能使溶液褪色的是SO2,不褪色的是CO2。
如果两种气体可能同时存在,则可先检验二氧化硫,然后除去二氧化硫,再检验二氧化碳。
如图:

说明一下,第二个洗气瓶中的品红溶液是检验二氧化硫是否除干净,不褪色证明除干净。也可以用较浓的高锰酸钾溶液,不使用第二个品红溶液,如果高锰酸钾溶液颜色变浅不褪色也可达到目的。
2、除去CO2中SO2的方法
可利用二氧化硫的还原性,用酸性高锰酸钾溶液、氯水、溴水等除去。
还可利用亚硫酸的酸性比碳酸强,用饱和碳酸氢钠溶液除去。但不能用碳酸钠溶液。
练习:
吸烟有害健康,因为香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水硫酸铜、②澄清石灰水、③红热氧化铜、④碱石灰、⑤品红溶液、⑥足量酸性高锰酸钾溶液等可将其一一检出,检出的正确顺序是( )
A.混合气→①→⑤→②→①→④→③
B.混合气→③→④→②→⑥→⑤→①
C.混合气→①→⑤→⑥→②→④→③
D.混合气→②→⑤→①→④→③→⑥
答案 C






